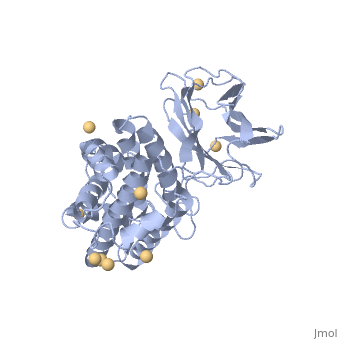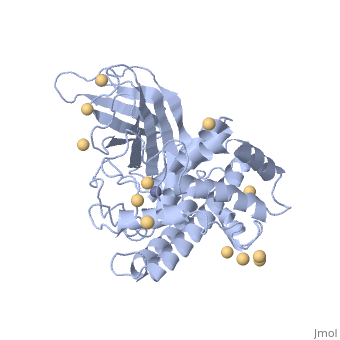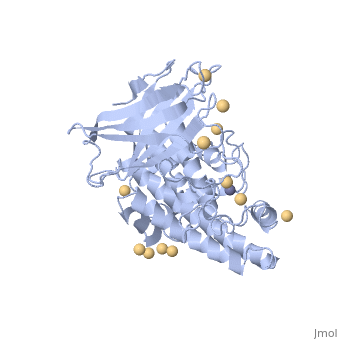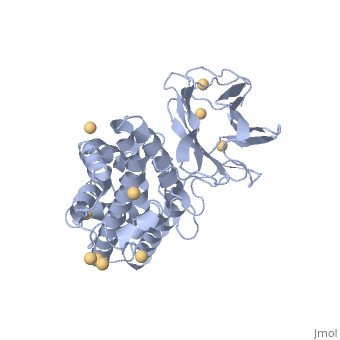1ca1 (French)

| |||||||||
| 1ca1, resolution 1.90Å () | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ligands: | , | ||||||||
| Gene: | CPA (Clostridium perfringens) | ||||||||
| Activity: | Phospholipase C, with EC number 3.1.4.3 | ||||||||
| |||||||||
| |||||||||
| Resources: | FirstGlance, OCA, PDBsum, RCSB | ||||||||
| Coordinates: | save as pdb, mmCIF, xml | ||||||||
TOXINE ALPHA DE CLOSTRIDIUM PERFRINGENSTOXINE ALPHA DE CLOSTRIDIUM PERFRINGENS
La toxine alpha de Clostridium perfringens est le facteur de virulence principal dans la gangrène gazeuse, et a aussi été impliquée dans la pathogenèse du syndrome de mort subite chez les jeunes animaux. La toxine est une zinc métalloenzyme de 370 résidus, qui possède une activité phospholipase C et peut se lier aux membranes en présence de calcium. La structure cristalline de l'enzyme révèle une protéine à deux domaines. Le domaine N-terminal montre une similitude structurale attendue avec la phospholipase C phosphatidylcholine-spécifique de Bacillus cereus (PC-PLC). Le domaine C-terminal montre une analogie structurale forte avec les domaines de liaison du calcium C2 eucaryotes. Nous pensons qu'il s'agit du premier exemple d'un tel domaine chez les procaryotes. Ce type de domaine peut agir comme phospholipide et/ou domaine de liaison du calcium dans les protéines second messager intracellulaires et, de manière intéressante, ces voies sont perturbées dans des cellules traitées à la toxine alpha. Finalement, un mécanisme pausible est décrit pour l'attaque de la toxine alpha sur les phospholipides empaquetés dans des membranes, ce qui rationalise sa toxicité comparée à d'autres phospholipases C homologues, non-hémolytiques.
Résumé traduit de MEDLINE®/PubMed®, une base de données de la U.S. National Library of Medicine.
CONTEXTECONTEXTE
La toxine alpha est la première toxine bactérienne dont l'activité enzymatique fut découverte en 1940 (Songer, JG, 1996; Titball, RW, 1993; Naylor, CE et al., 1998). Il s'agit d'une lécithinase (ou phospholipase de type C) et d'une sphyngomyélinase hydrolysant la phosphatydil-choline, la lécithine, les phospholipides et la sphyngomyéline (Popoff, MR, 2004; Billington, SJ et al., 1998; Lefevre, PC et al., 2003; Smith, BP, 1996; Titball, RW et al., 1999; Hirsh, DC et al., 2004). Elle possède une activité hémolytique, nécrosante et létale (Titball, RW et al., 1999; Hirsh, DC et al., 2004). La toxine alpha est sécrétée par tous les types de Clostridium perfringens et est synthétisée en phase de croissance exponentielle (Smith, BP, 1996; Songer, JG, 1996; Titball, RW et al., 1999). La toxine alpha est une protéine de poids moléculaire 43 kDa (Petit, L et al., 1999). Sa synthèse est réalisée à partir d'un précurseur comprenant un peptide signal (les premiers 28 acides aminés). La protéine mature est composée de 370 acides aminés et possède deux domaines; l'un est constitué d'hélices alpha en partie N-terminale (résidus 1-246), portion active de la toxine, l'autre est formé de deux feuillets beta, en partie C-terminale (résidus 256-370), impliqué dans la fixation membranaire (Popoff, MR, 2004). Il s'agit d'une métallo enzyme comprenant des ions Zn2+ et Ca2+ (Naylor, CE et al., 1998). Ces ions sont indispensables pour l'activité biologique: le zinc intervient dans l'activité enzymatique et le calcium intervient dans la fixation membranaire (Titball, RW et al., 1999). Le gène qui code pour la toxine alpha est appelé cpa (encore appelé plc). Il est situé sur le chromosome près de l'origine de réplication et d'initiation (Daube, G et al., 1996; Songer, JG, 1996). Sa séquence, constante dans toutes les souches identifiées, permet par conséquent de l'utiliser comme marqueur génétique de l'espèce (Petit, L et al., 1999). Le rôle de la toxine alpha consiste en une déstabilisation des membranes cellulaires. Le diacylglycérol, produit de l'hydrolyse de la lécithine par la toxine alpha, active la protéine kinase conduisant à l'activation des phospholipases C et D des cellules eucaryotes et à une cascade de réactions dues à l'acide arachidonique. Les phospholipases C et D des cellules eucaryotes engendrent la synthèse et l'attraction des molécules de l'inflammation comme les leucotriènes, les thromboxanes et les facteurs d'activation des plaquettes. Ces réactions entrainent la contraction des vaisseaux sanguins, une augmentation de la perméabilité, l'agrégation plaquettaire et un dysfonctionnement des muscles (le myocarde en particulier). L'activité biologique de la toxine alpha se traduit par la lyse membranaires des cellules cibles comme les leucocytes ou les entérocytes (Lefevre, PC et al., 2003; Petit, L et al., 1999; Smith, BP, 1996; Minor, L & Véron, M, 1989). Des expériences ont permis de mettre en évidence ces effets pathogènes par injection intraveineuse ou intra-péritonéale de cette toxine (Bunting, M et al., 1997; Titball, RW et al., 1999). La toxine alpha possède une action hémolytique. Ceci la différencie des phospholipases A, dont l'action hémolytique s'effectue à partir de produits hémolytiques (Minor, L & Véron, M, 1989). Néanmoins ces produits interviennent dans l'activation de multiples réactions altérant le métabolisme cellulaire conduisant à la déstabilisation des cellules (Bunting, M et al., 1997). La toxine alpha modifie la perméabilité des endothéliums et provoque la nécrose des villosités intestinales (Smith, BP, 1996). Des études menées par Songer tendent à montrer que l'infime différence de la séquence en acides aminés de la toxine alpha, entre les toxi-infections gangréneuses et les entérotoxémies, confère à la toxine alpha une résistance particulière vis-à-vis de la chymotrypsine permettant son accumulation dans l'intestin (Songer, JG, 1996).
Au sujet de cette StructureAu sujet de cette Structure
1CA1 est une structure à 1 chaîne de séquence de Clostridium perfringens. Des informations cristallographique complètes sont disponibles sur OCA.
RéférencesRéférences
- ↑ Naylor CE, Eaton JT, Howells A, Justin N, Moss DS, Titball RW, Basak AK. Structure of the key toxin in gas gangrene. Nat Struct Biol. 1998 Aug;5(8):738-46. PMID:9699639 doi:10.1038/1447
- ↑ Popoff MR. Clostridial and Bacteroides Toxins: Structure and Mode of Action. In "Strict and Facultative Anaerobes Medical and Environmental Aspects" (Nakano, MM & Zuber, P eds), Horizon Bioscience, Norfolk, 2004, pp. 171-197.
- ↑ Smith, BP. Diseases caused by Clostridium perfringens toxins, in 'Large animal internal medicine. Diseases of horses, cattle, sheep and goat' 2nd edition, Mosby, 1996, pp. 768-771
- ↑ Titball, RW, Naylor CE, Basak AK. The Clostridium perfringens alpha-toxin. Anaerobe 1999 Apr; 5(1):51-64
- ↑ Hirsh, DC, Biberstein, EL. Clostridium, in "Veterinary microbiology" 2nd édition (Walker, RL, Hersh, DC, Maclachlan, NJ eds), Wiley-Blackwell, 2004, pp. 198-214
- ↑ Petit, L, Gibert, M, Popoff, MR. Clostridium perfringens: toxinotype and genotype. Trends Microbiol. 1999 Mar; 7(3):104-110
- ↑ Daube G, Simon P, Limbourg B, Manteca C, Mainil J, Kaeckenbeeck A. Hybridization of 2,659 Clostridium perfringens isolates with gene probes for seven toxins (alpha, beta, epsilon, iota, theta, mu, and enterotoxin) and for sialidase. Am J Vet Res. 1996 Apr;57(4):496-501. PMID:8712513
- ↑ Minor, L, Véron, M. Clostridium perfringens in "Bacteriologie médicale. Medicine et Sciences" 2nd edition, Flammarion, 1989, pp. 902-911
- ↑ Bunting M, Lorant DE, Bryant AE, Zimmerman GA, McIntyre TM, Stevens DL, Prescott SM. Alpha toxin from Clostridium perfringens induces proinflammatory changes in endothelial cells. J Clin Invest. 1997 Aug 1;100(3):565-74. PMID:9239403 doi:10.1172/JCI119566
Page seeded by OCA on Wed Feb 18 09:15:01 2009