Fadel A. Samatey Group (Japanese): Difference between revisions
No edit summary |
Eric Martz (talk | contribs) |
||
| Line 22: | Line 22: | ||
==Contributions from OIST== | ==Contributions from OIST== | ||
Samatey joined OIST in 2007. | Samatey joined OIST in 2007. | ||
<ref group="xtra">PMID: 21904035</ref><references group="xtra" /> | |||
<ref group="xtra">PMID: 21795800</ref><references group="xtra" /> | |||
Revision as of 01:40, 18 October 2011
サマテ研究室
- This article in English: Fadel A. Samatey Group.
Translation of this article to Japanese is in progress.
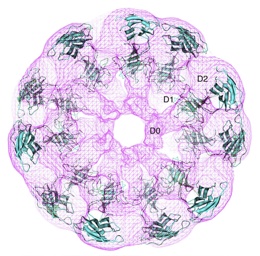 | |
| Crystal structure of flagellar hook fitted into electron density map obtained by electron cryomicroscopy[1]. |
ファデル・A・サマテは、沖縄科学技術研究基盤整備機構 (OIST)(日本)の細胞膜通過輸送研究室の代表研究者である。サマテグループでは、X-線結晶解析、遺伝学的および生化学的手法を用いて膜透過タンパク質、特に細菌鞭毛のⅢ型分泌タンパク質の構造および機能の解明を行っている。
下記は、サマテグループの最新の業績の一覧である。
対象および目的対象および目的
運動性は、生物界において非常に重要な機能である。このために、細菌などの生物は非常に驚くべき分子装置である鞭毛システムを発達させた。大腸菌やネズミチフス菌のような細菌は、この鞭毛と呼ばれる長いらせん状の繊維を回転させて泳ぐことができる。鞭毛は、多くの異なるタンパク質の重合によって作られる複合体で以下の3つの部分に分けることができる。1) 繊維:らせん型のプロペラとして機能する長くて堅い管状構造、2) フック:ユニバーサルジョイントとして働く短くて非常に柔軟な管状部分、および3) 基底小体:細胞膜中に埋め込まれた回転モーター。
鞭毛が形成される過程では、すべての鞭毛軸タンパク質はその中心にある2~3 nmのチャネルを通して細胞質から鞭毛の先端へと輸送される。この輸送メカニズムは、基底小体の細胞質側に位置する特殊なタンパク質輸送系により調節されている。これは、III型輸送装置と呼ばれて細菌界に広く存在している。サルモネラ菌の場合、この輸送装置は6つの膜タンパク質:FlhA、FlhB、FliO、FliP、FliQ、FliRおよび3つの細胞質タンパク質:FliI、FliHおよびFliJから形成されている。また、細菌鞭毛の輸送装置は、グラム陰性病原菌に見られるIII型分泌系(T3SS)に類似している。T3SSの役割は、宿主細胞に対して毒性因子を分泌し、多様な疾患を引き起こすことである。細菌の鞭毛およびT3SSを理解するために、鞭毛タンパク質の構造研究および輸送装置の遺伝学的研究を行っている。
連絡先: f.a.samatey at oist jp
Contributions from OISTContributions from OIST
Samatey joined OIST in 2007.
- ↑ Meshcheryakov VA, Krieger I, Kostyukova AS, Samatey FA. Structure of a tropomyosin N-terminal fragment at 0.98 A resolution. Acta Crystallogr D Biol Crystallogr. 2011 Sep;67(Pt 9):822-5. Epub 2011, Aug 9. PMID:21904035 doi:10.1107/S090744491102645X
- ↑ Meshcheryakov VA, Samatey FA. Purification, crystallization and preliminary X-ray crystallographic analysis of the C-terminal cytoplasmic domain of FlhB from Salmonella typhimurium. Acta Crystallogr Sect F Struct Biol Cryst Commun. 2011 Jul 1;67(Pt, 7):808-11. Epub 2011 Jun 30. PMID:21795800 doi:10.1107/S1744309111018938
- ↑ Meshcheryakov VA, Yoon YH, Samatey FA. Purification, crystallization and preliminary X-ray crystallographic analysis of the C-terminal cytoplasmic domain of FlhB from Aquifex aeolicus. Acta Crystallogr Sect F Struct Biol Cryst Commun. 2011 Feb 1;67(Pt, 2):280-2. Epub 2011 Jan 27. PMID:21301106 doi:10.1107/S1744309110052942
- ↑ Barker CS, Meshcheryakova IV, Kostyukova AS, Samatey FA. FliO regulation of FliP in the formation of the Salmonella enterica flagellum. PLoS Genet. 2010 Sep 30;6(9). pii: e1001143. PMID:20941389 doi:10.1371/journal.pgen.1001143
OIST以前のサマテの業績OIST以前のサマテの業績
OISTに参加する前、サマテは1996年~2007年に難波啓一研究室のメンバーとして、1996年からは松下電器、1997年からは ERATOのプロトニック・ナノマシン・プロジェクト 、2002年からは 大阪大学(日本)に在籍した。サマテは、1992年に Université Joseph Fourier大学(フランス・グルノーブル)で博士号を取得した。
 | |
| Simplified model of the rotating bacterial flagellar hook. |
- ↑ Furuta T, Samatey FA, Matsunami H, Imada K, Namba K, Kitao A. Gap compression/extension mechanism of bacterial flagellar hook as the molecular universal joint. J Struct Biol. 2007 Mar;157(3):481-90. Epub 2006 Oct 20. PMID:17142059 doi:10.1016/j.jsb.2006.10.006
鞭毛フックのモノマー が、フックが回転する際互いに滑ることにより、回転トルクを伝達しながら曲がるのを許容する機序の解析。
- ↑ Kitao A, Yonekura K, Maki-Yonekura S, Samatey FA, Imada K, Namba K, Go N. Switch interactions control energy frustration and multiple flagellar filament structures. Proc Natl Acad Sci U S A. 2006 Mar 28;103(13):4894-9. Epub 2006 Mar 20. PMID:16549789 doi:10.1073/pnas.0510285103
細菌鞭毛繊維における多形性スーパーコイル形成を合理的に説明する大規模分子動力学シミュレーションの解説。タンパク質モノマー鎖同士の相互作用は、パーマネント相互作用、スライディング相互作用、およびスイッチ相互作用のカテゴリーに細分される。
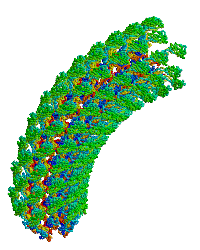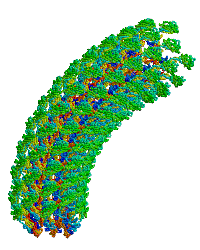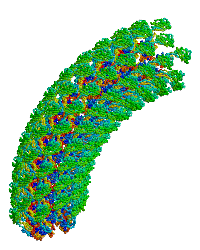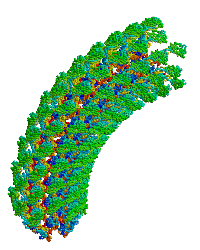 | |
| Bacterial flagellar hook. |
|
- ↑ Samatey FA, Matsunami H, Imada K, Nagashima S, Shaikh TR, Thomas DR, Chen JZ, Derosier DJ, Kitao A, Namba K. Structure of the bacterial flagellar hook and implication for the molecular universal joint mechanism. Nature. 2004 Oct 28;431(7012):1062-8. PMID:15510139 doi:http://dx.doi.org/10.1038/nature02997
細菌鞭毛フックへ重合するタンパク質モノマーの主要なフラグメントの構造に関する初の報告(1wlg、 分解能1.8 Å)。このモノマーを極低温電子顕微鏡の密度図に適合させた結果、回転モデルを含む直線型および曲がったフックのモデルが得られた。
- ↑ Samatey FA, Matsunami H, Imada K, Nagashima S, Namba K. Crystallization of a core fragment of the flagellar hook protein FlgE. Acta Crystallogr D Biol Crystallogr. 2004 Nov;60(Pt 11):2078-80. Epub 2004, Oct 20. PMID:15502333 doi:10.1107/S0907444904022735
|
- ↑ Samatey FA, Imada K, Nagashima S, Vonderviszt F, Kumasaka T, Yamamoto M, Namba K. Structure of the bacterial flagellar protofilament and implications for a switch for supercoiling. Nature. 2001 Mar 15;410(6826):331-7. PMID:11268201 doi:10.1038/35066504
細菌鞭毛繊維へ重合するタンパク質鎖モノマーの主要なフラグメントの原子構造に関する初の報告(1io1、分解能 2.0 Å)。この結晶はモノマーの連鎖を含み、この結晶によりこれらのモノマータンパク質鎖がどのように素繊維に組み合わさるかが明らかになった。理論的シミュレーションにより、この繊維がどのように反転するかについての考えられうる機序、つまり細菌がどのように鞭毛モーターを反転させて栄養物質の方向へ泳ぐか、またはどのように危害から離れるように泳ぐかに関する重要なメカニズムが明らかになった。
- ↑ Samatey FA, Imada K, Vonderviszt F, Shirakihara Y, Namba K. Crystallization of the F41 fragment of flagellin and data collection from extremely thin crystals. J Struct Biol. 2000 Nov;132(2):106-11. PMID:11162732 doi:10.1006/jsbi.2000.4312
 | Crystals of the flagellar hook protein produced in the Samatey lab. |
1990's1990's
- ↑ Lazzaroni JC, Vianney A, Popot JL, Benedetti H, Samatey F, Lazdunski C, Portalier R, Geli V. Transmembrane alpha-helix interactions are required for the functional assembly of the Escherichia coli Tol complex. J Mol Biol. 1995 Feb 10;246(1):1-7. PMID:7853390 doi:http://dx.doi.org/10.1006/jmbi.1994.0058
See AlsoSee Also
ReferencesReferences
- ↑ Samatey FA, Matsunami H, Imada K, Nagashima S, Shaikh TR, Thomas DR, Chen JZ, Derosier DJ, Kitao A, Namba K. Structure of the bacterial flagellar hook and implication for the molecular universal joint mechanism. Nature. 2004 Oct 28;431(7012):1062-8. PMID:15510139 doi:http://dx.doi.org/10.1038/nature02997